Neuer Katalysator erzeugt Methan aus Strom, CO2 und Wasser
 Grafik: Nikolay Kornienko
Grafik: Nikolay KornienkoMit Hilfe von Strom speicherbare Kohlenwasserstoffe zu erzeugen, ist ein in jüngster Zeit viel erforschtes Feld. Meist geht der Weg dabei über die Elektrolyse. Mit Strom wird Wasser in H2 und O2 zerlegt, im nächsten Schritt aus dem Wasserstoff das Methan oder andere Moleküle hergestellt, zum Beispiel Methanol.
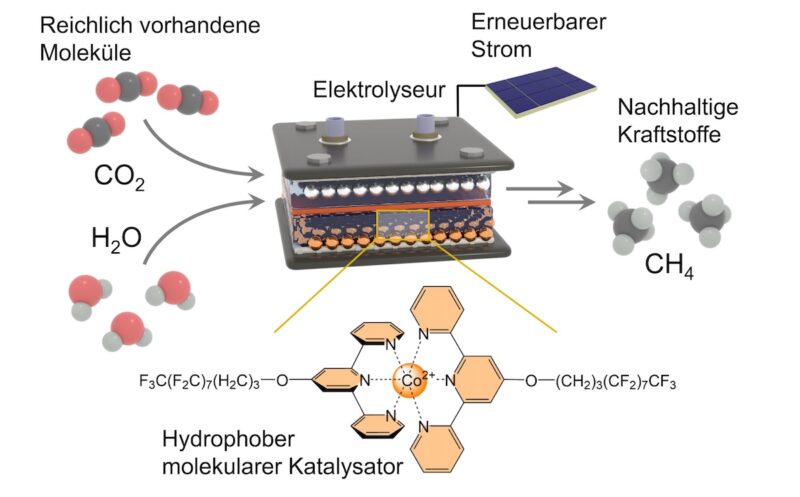
Doch die Forschenden der Universitäten Bonn und Montreal gehen es anders an. Sie nutzten eine sogenannte Gasdiffusions-Elektrode, um CO2 und Wasser zusammenzubringen – ein Gas und eine Flüssigkeit, was an sich schon eine Herauforerung ist. Bei der Reaktion müssen die beiden Sauerstoff-Atome (O) im CO2 vom Kohlenstoff-Atom (C) abgetrennt und durch vier Wasserstoff-Atome (H) ersetzt werden. Der Wasserstoff stammt auch bei dieser Reaktion aus Wasser. Die elektrolytische Abspaltung des reinen Wasserstoffs ist aber explizit unerwünscht. „Das ist eine Konkurrenz-Reaktion, die wir ausschließen müssen“, betont Morgan McKee, der einen großen Teil der Experimente durchgeführt hat. „Andernfalls würde sie dafür sorgen, dass kein Methan entsteht. Wir müssen also verhindern, dass Wasser in Kontakt zur Elektrode gerät. Gleichzeitig benötigen wir es aber als Reaktionspartner.“
Hier kommt der neu entwickelte Katalysator ins Spiel, der auf die Elektrode aufgebracht wird. Er erleichtert vor allem die Reaktion von Kohlendioxid zu Methan. Das macht er mit seinem sogenannten aktiven Zentrum: Damit hält er das Kohlendioxid fest; gleichzeitig schwächt er die Bindungen zwischen dem Kohlenstoff-Atom und den beiden Sauerstoff-Atomen.
Im nächsten Schritt werden die Sauerstoff-Atome sukzessive durch vier Wasserstoff-Atome ersetzt. Dazu benötigt der Katalysator Wasser. Allerdings muss er es gleichzeitig auf Abstand halten, um unerwünschte Nebenreaktionen zu verhindern. „Um das zu erreichen, haben wir lange Molekülketten an das aktive Zentrum gebunden“, erklärt Professor Nikolay Kornienko vom Institut für Anorganische Chemie der Universität Bonn. „Diese sind chemisch so aufgebaut, dass sie Wasser abstoßen – wir sagen auch: sie sind hydrophob.“
Diese hydrophoben Seitenketten halten die H2O-Moleküle einerseits vom aktiven Zentrum und der Elektrode fern. Zugleich dienen sie aber als eine Art Transportband. Bildlich gesprochen, entreißen sie Wassermolekülen Wasserstoff-Atome und schaffen diese zum aktiven Zentrum, wo sie mit dem Kohlenstoff-Atom reagieren. In der Summe entsteht so in mehreren Schritten aus dem CO2 das CH4 – also Methan.
Die sogenannte Faradaische Effizienz ist in der Veröffentlichung in Nature Chemistry mit „über 80 Prozent“ angegeben. Sie wurde allerdings nur bei kleinen Labor-Versuchen gemessen. Der bisher getestete Katalysator eigne sich nicht für die Herstellung von Methan in großem Maßstab, räumen die Forschenden ein. „Die Reaktionsprinzipien, die wir in ihm verwirklicht haben, lassen sich aber auch in anderen Katalysatormaterialien realisieren, die sich großtechnisch einsetzen lassen“, sagt Professor Kornienko.
Quelle: Uni Bonn /idw | www.solarserver.de © Solarthemen Media GmbH